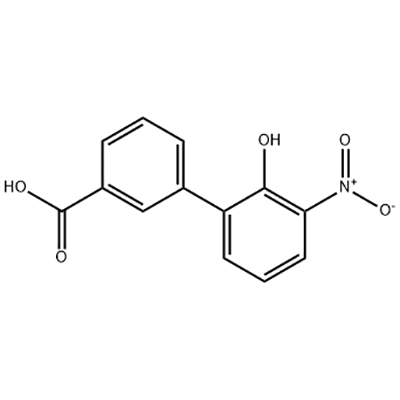
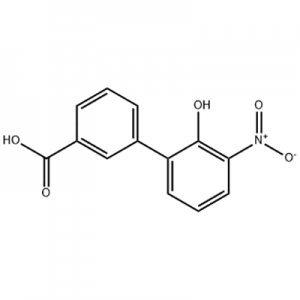
2′-ਹਾਈਡ੍ਰੋਕਸੀ-3′-ਨਾਈਟਰੋ-3-ਬਾਈਫੇਨਿਲਕਾਰਬੋਕਸਾਈਲਿਕ ਐਸਿਡ
2′-ਹਾਈਡ੍ਰੋਕਸੀ-3′-ਨਾਈਟਰੋ-3-ਬਾਈਫੇਨਿਲਕਾਰਬੋਕਸਾਈਲਿਕ ਐਸਿਡ
2'-hydroxy-3'-nitro-3-biphenylcarboxylic acid ਨੂੰ Eltrombopag ਦੇ ਵਿਚਕਾਰਲੇ ਹਿੱਸੇ ਵਜੋਂ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ।
ਐਲਟ੍ਰੋਮਬੋਪੈਗ, ਯੂਕੇ ਵਿੱਚ ਗਲੈਕਸੋਸਮਿਥਕਲਾਈਨ (ਜੀਐਸਕੇ) ਦੁਆਰਾ ਵਿਕਸਤ ਕੀਤਾ ਗਿਆ ਅਤੇ ਬਾਅਦ ਵਿੱਚ ਸਵਿਟਜ਼ਰਲੈਂਡ ਵਿੱਚ ਨੋਵਾਰਟਿਸ ਨਾਲ ਸਾਂਝੇ ਤੌਰ 'ਤੇ ਵਿਕਸਤ ਕੀਤਾ ਗਿਆ, ਦੁਨੀਆ ਵਿੱਚ ਪਹਿਲਾ ਅਤੇ ਇੱਕੋ ਇੱਕ ਪ੍ਰਵਾਨਿਤ ਛੋਟਾ ਅਣੂ ਗੈਰ-ਪੈਪਟਾਇਡ ਟੀਪੀਓ ਰੀਸੈਪਟਰ ਐਗੋਨਿਸਟ ਹੈ।ਐਲਟ੍ਰੋਮਬੋਪੈਗ ਨੂੰ 2008 ਵਿੱਚ ਯੂਐਸ ਐਫ ਡੀ ਏ ਦੁਆਰਾ ਇਡੀਓਪੈਥਿਕ ਥ੍ਰੋਮੋਸਾਈਟੋਪੈਨਿਕ ਪਰਪੁਰਾ (ਆਈਟੀਪੀ) ਦੇ ਇਲਾਜ ਲਈ ਅਤੇ 2014 ਵਿੱਚ ਗੰਭੀਰ ਅਪਲਾਸਟਿਕ ਅਨੀਮੀਆ (ਏਏ) ਦੇ ਇਲਾਜ ਲਈ ਮਨਜ਼ੂਰੀ ਦਿੱਤੀ ਗਈ ਸੀ।ਇਹ ਹਾਲ ਹੀ ਦੇ 30 ਸਾਲਾਂ ਵਿੱਚ AA ਦੇ ਇਲਾਜ ਲਈ US FDA ਦੁਆਰਾ ਪ੍ਰਵਾਨਿਤ ਪਹਿਲੀ ਦਵਾਈ ਵੀ ਹੈ।
ਦਸੰਬਰ 2012 ਵਿੱਚ, ਯੂਐਸ ਐਫ ਡੀ ਏ ਨੇ ਕ੍ਰੋਨਿਕ ਹੈਪੇਟਾਈਟਸ ਸੀ (ਸੀਐਚਸੀ) ਵਾਲੇ ਮਰੀਜ਼ਾਂ ਵਿੱਚ ਥ੍ਰੋਮਬੋਸਾਈਟੋਪੇਨੀਆ ਦੇ ਇਲਾਜ ਲਈ ਐਲਟ੍ਰੋਮਬੋਪੈਗ ਨੂੰ ਮਨਜ਼ੂਰੀ ਦਿੱਤੀ, ਤਾਂ ਜੋ ਹੈਪੇਟਾਈਟਸ ਸੀ ਦੇ ਮਰੀਜ਼ ਘੱਟ ਪਲੇਟਲੇਟ ਗਿਣਤੀ ਦੇ ਕਾਰਨ ਮਾੜੇ ਪੂਰਵ-ਅਨੁਮਾਨ ਵਾਲੇ ਜਿਗਰ ਦੇ ਰੋਗਾਂ ਲਈ ਇੰਟਰਫੇਰੋਨ ਅਧਾਰਤ ਮਿਆਰੀ ਥੈਰੇਪੀ ਸ਼ੁਰੂ ਕਰ ਸਕਣ ਅਤੇ ਕਾਇਮ ਰੱਖ ਸਕਣ।ਫਰਵਰੀ 3,2014 ਨੂੰ, ਗਲੈਕਸੋਸਮਿਥਕਲਾਈਨ ਨੇ ਘੋਸ਼ਣਾ ਕੀਤੀ ਕਿ FDA ਨੇ ਗੰਭੀਰ ਕੈਮੀਕਲਬੁੱਕ ਅਪਲਾਸਟਿਕ ਅਨੀਮੀਆ (SAA) ਵਾਲੇ ਮਰੀਜ਼ਾਂ ਵਿੱਚ ਹੀਮੋਪੇਨੀਆ ਦੇ ਇਲਾਜ ਲਈ Eltrombopag ਦੀ ਸਫਲਤਾਪੂਰਵਕ ਇਲਾਜ ਦਵਾਈ ਯੋਗਤਾ ਪ੍ਰਦਾਨ ਕੀਤੀ ਹੈ ਜਿਨ੍ਹਾਂ ਨੇ ਇਮਯੂਨੋਥੈਰੇਪੀ ਲਈ ਪੂਰੀ ਤਰ੍ਹਾਂ ਜਵਾਬ ਨਹੀਂ ਦਿੱਤਾ।24 ਅਗਸਤ, 2015 ਨੂੰ, ਯੂਐਸ ਐਫ ਡੀ ਏ ਨੇ 1 ਸਾਲ ਜਾਂ ਇਸ ਤੋਂ ਵੱਧ ਉਮਰ ਦੇ ਬਾਲਗਾਂ ਅਤੇ ਪੁਰਾਣੇ ਇਮਿਊਨ ਥ੍ਰੋਮਬੋਸਾਈਟੋਪੇਨੀਆ (ITP) ਵਾਲੇ ਬੱਚਿਆਂ ਵਿੱਚ ਥ੍ਰੋਮੋਬੋਸਾਈਟੋਪੇਨੀਆ ਦੇ ਇਲਾਜ ਲਈ ਐਲਟ੍ਰੋਮਬੋਪੈਗ ਨੂੰ ਮਨਜ਼ੂਰੀ ਦਿੱਤੀ, ਜਿਨ੍ਹਾਂ ਕੋਲ ਕੋਰਟੀਕੋਸਟੀਰੋਇਡਜ਼, ਇਮਯੂਨੋਗਲੋਬੂਲਿਨ ਜਾਂ ਸਪਲੇਨੈਕਟੋਮੀ ਲਈ ਨਾਕਾਫ਼ੀ ਪ੍ਰਤੀਕਿਰਿਆ ਹੈ।ਜਨਵਰੀ 4, 2018 ਨੂੰ, ਐਲਟ੍ਰੋਮਬੋਪੈਗ ਨੂੰ ਪ੍ਰਾਇਮਰੀ ਇਮਿਊਨ ਥ੍ਰੋਮਬੋਸਾਈਟੋਪੇਨੀਆ (ITP) ਦੇ ਇਲਾਜ ਲਈ ਚੀਨ ਵਿੱਚ ਸੂਚੀਬੱਧ ਕਰਨ ਲਈ ਮਨਜ਼ੂਰੀ ਦਿੱਤੀ ਗਈ ਸੀ।


![ਕੈਸਪ ਅਨਗਿਨ ਐਸੀਟੇਟ;ਕਾਸਪੋਫੰਗਿਨ ਐਸੀਟੇਟ;ਕੈਨਸੀਡਾਸ;ਕਾਸਪੋਫੰਗਿਨ ਐਸੀਟੇਟ [ਯੂਐਸਏਐਨ: ਬੈਨ: ਜੈਨ];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)


![2-ਬਿਊਟਾਇਲ-5-ਨਾਈਟਰੋ-3-ਬੈਂਜ਼ੋਫੁਰਾਨਿਲ)[4-[3-(ਡਾਈਬਿਊਟਿਲਮੀਨੋ)ਪ੍ਰੋਪੌਕਸੀ]ਫੀਨਾਇਲ]](http://cdn.globalso.com/jindunchem-med/922e79ba.jpg)
